Categories: Articles destacats » Electricistes novells
Nombre de visualitzacions: 36288
Comentaris sobre l'article: 1
Fonts de corrent químic: característiques principals
 Durant més de dos segles, la humanitat ha estat utilitzant l’energia de les reaccions químiques entre diverses substàncies per produir corrent directe.
Durant més de dos segles, la humanitat ha estat utilitzant l’energia de les reaccions químiques entre diverses substàncies per produir corrent directe.
Principi de treball
La reacció redox que es produeix entre substàncies amb les propietats d’un agent oxidant i un agent reductor s’acompanya de l’alliberament d’electrons, el moviment del qual forma un corrent elèctric. Tanmateix, per utilitzar la seva energia és necessari crear condicions per al pas d’electrons a través d’un circuit extern; d’altra manera, s’allibera per calor d’una simple barreja d’un agent oxidant i d’un agent reductor.
Per tant, totes les fonts de corrent químic tenen dos elèctrodes:
-
l’ànode sobre el qual es produeix l’oxidació;
-
càtode, realitzant la restauració de la substància.
Els elèctrodes a distància es col·loquen en un recipient amb un electròlit - una substància que condueix el corrent elèctric a causa dels processos de dissociació del medi en ions.
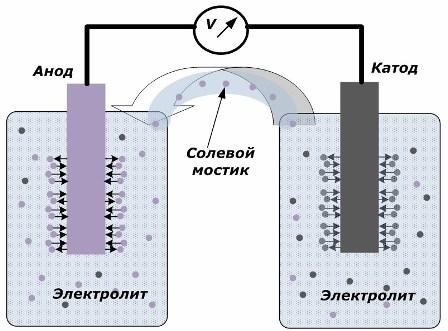
El principi de conversió de l’energia química en energia elèctrica
La figura mostra que els elèctrodes es col·loquen en recipients separats connectats per un pont de sal a través del qual es crea el moviment dels ions al llarg del circuit intern. Quan els circuits externs i interns estan oberts, es produeixen dos processos en els elèctrodes: la transició d’ions del metall de l’elèctrode a l’electròlit i la transició d’ions de l’electròlit al gel de cristall dels elèctrodes.
Els cabals d’aquests processos són els mateixos i els potencials de tensió dels signes oposats s’acumulen a cada elèctrode. Si es connecten a través d’un pont salat i s’aplica una càrrega, es produirà un circuit elèctric. Un corrent intern es genera pel moviment dels ions entre els elèctrodes a través de l'electròlit i el pont de sal. El moviment dels electrons al llarg del circuit extern en la direcció de l’anode al càtode.
Gairebé totes les reaccions redox s’acompanyen de la generació d’electricitat. Però el seu valor depèn de molts factors, inclosos els volums i les masses dels productes químics utilitzats, els materials utilitzats per fabricar els elèctrodes, com l'electròlit, la concentració d'ions, el disseny.
Els més utilitzats en les fonts actuals de productes químics són:
-
per al material de l’ànode (agent reductor) - zinc (Zn), plom (Pb), cadmi (Cd) i alguns altres metalls;
-
per al material catòdic (oxidant) - òxid de plom PbO2, òxid de manganès MnO2, hidròxid de níquel NiOOH i altres;
-
electròlits basats en solucions d’àcids, àlcalis o sals.
Mètodes de classificació
Una part de les fonts d’energia química es pot reutilitzar, mentre que l’altra no. Aquest principi es pren com a base per a la seva classificació.
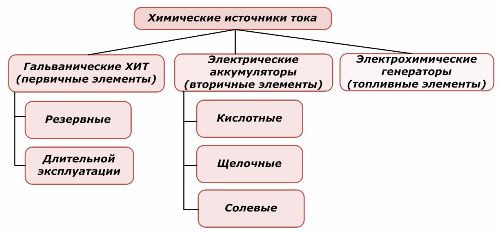
Classificació dels elements químics
Força electromotriu cèl·lules galvàniques, segons el disseny, assoleix 1,2 ÷ 1,5 volts. Per obtenir grans valors, es combinen en bateries, connectant-se en sèrie. Quan les bateries es connecten en paral·lel, augmenta la corrent i la potència.
Generalment s’accepta que les fonts de corrents químiques primàries no admetin recàrrega, tot i que amb més precisió aquesta posició es pot formular de manera diferent: la seva implementació no és factible econòmicament.
Les fonts de corrent químic primari redundant s’emmagatzemen en un estat on l’electròlit queda aïllat dels elèctrodes. Això elimina l'ocurrència de la reacció redox i garanteix la preparació per començar. No es reutilitzen. La vida útil de les fonts d’energia de còpia de seguretat química està limitada a 10-15 anys.
L’aplicació d’energia elèctrica externa es recarrega amb èxit les bateries. A causa d’aquesta característica, s’anomenen fonts de corrent secundàries. Són capaços de suportar centenars i milers de cicles de descàrrega de càrrega.L’EMF de la bateria pot estar en un rang d’1,0 ÷ 1,5 volts. També es combinen en bateries.
Els generadors electroquímics funcionen amb el principi de les cèl·lules galvàniques, però per dur a terme la reacció electroquímica, les substàncies provenen de fora i tots els productes alliberats s’eliminen de l’electròlit. Això permet organitzar un procés continu.
Característiques clau del rendiment de les fonts d’energia química
1. La tensió entre els terminals oberts
Segons el disseny, una sola font només pot crear una certa diferència de potencial. Per a ús en dispositius elèctrics, es combinen en bateries.
2. Capacitat específica
Durant un temps determinat (en hores), una font de corrent químic pot generar una quantitat limitada de corrent (en amperis), que s’atribueixen a una unitat de pes o volum.
3. Densitat de potència
Caracteritza la capacitat d’una unitat de pes o volum d’una font de corrent químic per generar energia generada pel producte de tensió per la força del corrent.
4. Durada del funcionament
Aquest paràmetre també s’anomena data de caducitat.
5. El valor dels corrents d’auto-descàrrega
Aquests processos laterals de reaccions electroquímiques condueixen al consum de la massa activa dels elements, provoquen corrosió i redueixen la capacitat específica.
6. Preu del producte
Depèn del disseny, els materials utilitzats i d'altres factors.
Les millors fonts de corrent químic són aquelles amb valors alts dels primers quatre paràmetres, i l’autocàrrega i el cost són baixos.
Principis de càrrega de la bateria
Entre les fonts actuals de productes químics secundaris, estan guanyant gran popularitat. models d’ions de liti, que han estat molt utilitzats per alimentar dispositius electrònics. Utilitzen LiMO2 (M Co, Ni, Mn) com a material de l'elèctrode positiu i el grafit com a elèctrode negatiu.
Quan es carrega, els ions de liti procedents de l’energia externa aplicada s’alliberen del metall catòdic, passen per l’electròlit i penetren a l’espai entre les capes de grafit, acumulant-se allà mateix.
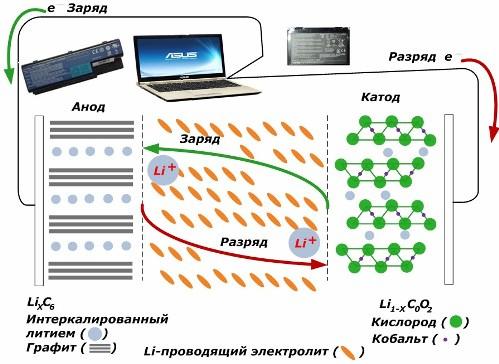
Quan l’energia carregador no hi ha, i la càrrega es connecta als elèctrodes, i els ions de liti de l'electròlit es mouen en el sentit contrari.
Si no es realitza la càrrega i descàrrega, l’energia de la bateria no es consumeix, sinó que s’emmagatzema. Però la seva quantitat està limitada per les propietats dels materials emprats. Per exemple, en les bateries d’ions de liti, la capacitat elèctrica específica és de 130 ÷ 150 mAh / g. Està limitat per les propietats del material anòdic. Per al grafit, la capacitat és aproximadament dues vegades superior.
Els científics ara estan buscant maneres d’augmentar la capacitat de la bateria i estan explorant la possibilitat d’utilitzar una reacció química entre el liti i l’oxigen a l’aire. Per fer-ho, es desenvolupen dissenys amb un càtode que no pot consumir-se a l’aire, que s’utilitza en bateries separades. Aquest mètode pot augmentar la densitat d’energia fins a 10 vegades.
El funcionament de les fonts de corrent químic requereix coneixement fonaments de l’enginyeria elèctrica, electroquímica, ciència dels materials i física de l'estat sòlid.
Consulteu també a electro-ca.tomathouse.com
:
