Categories: Electricistes novells, Electricista industrial
Nombre de visualitzacions: 37528
Comentaris sobre l'article: 0
L’aplicació pràctica de l’electròlisi
Quan un corrent elèctric passa per una solució o una fusió d’electròlits, els soluts o altres substàncies que són productes de reaccions secundàries sobre els elèctrodes s’alliberen sobre els elèctrodes. Aquest procés fisicoquímic s’anomena electròlisi.
L’essència de l’electròlisi
En el camp elèctric creat pels elèctrodes, els ions del fluid conductor condueixen en un moviment ordenat. L’elèctrode negatiu és el càtode, el positiu és l’ànode.
Els ions negatius anomenats anions (ions del grup hidroxil i residus àcids) es precipiten a l’ànode, i els ions positius anomenats cations (hidrogen, metall, ions amoni, etc.) s’afanyen al càtode.
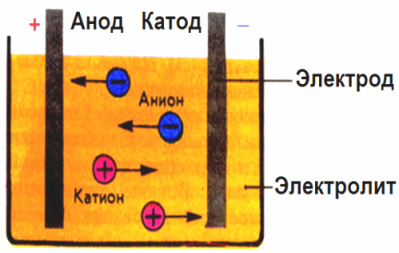
Es produeix un procés d’oxidació-reducció als elèctrodes: es produeix una reducció electroquímica de partícules (àtoms, molècules, cations) al càtode, i l’oxidació electroquímica de partícules (àtoms, molècules, anions) es produeix a l’ànode. Les reaccions de dissociació en un electròlit són reaccions primàries i les reaccions que es produeixen directament als elèctrodes s’anomenen secundàries.
Les lleis de l'electròlisi de Faraday
La separació de les reaccions d’electròlisi en primària i secundària va ajudar a Michael Faraday a establir les lleis de l’electròlisi:
-
La primera llei de l’electròlisi de Faraday: la massa de la substància dipositada a l’elèctrode durant l’electròlisi és directament proporcional a la quantitat d’electricitat transferida a aquest elèctrode. Per quantitat d’electricitat es vol dir una càrrega elèctrica, mesurada, per regla general, en penjolls.
-
Segona llei de l’electròlisi de Faraday: per a una quantitat determinada d’electricitat (càrrega elèctrica), la massa d’un element químic dipositat a l’elèctrode és directament proporcional a la massa equivalent de l’element. La massa equivalent d’una substància és la seva massa molar dividida per un nombre enter, depenent de la reacció química en què es troba la substància.
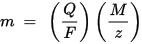
m és la massa de la substància dipositada a l’elèctrode, Q és la càrrega elèctrica total que passa per la substància F = 96.485,33 (83) C mol - 1 és la constant de Faraday, M és la massa molar de la substància (per exemple, la massa molar d’aigua H2O = 18 g / mol), z és el nombre de valència d’ions d’una substància (el nombre d’electrons per ió).
Tingueu en compte que M / z és la massa equivalent de la substància precipitada. Per a la primera llei de Faraday, M, F i z són constants, per tant, com més gran sigui el valor de Q, major serà el valor de m. Per a la segona llei de Faraday, Q, F i z són constants, de manera que com més gran sigui el valor de M / z (massa equivalent), més gran serà el valor de m.
L’electròlisi s’utilitza àmpliament avui dia en la indústria i en la tecnologia. Per exemple, l’electròlisi és un dels mètodes més eficients per a la producció industrial d’hidrogen, peròxid d’hidrogen, diòxid de manganès, alumini, sodi, magnesi, calci i altres substàncies. L’electròlisi s’utilitza per tractar les aigües residuals, en la galvanització, en la galvanització i, finalment, en fonts de corrent químic. Però primer les coses primer.
Obtenció de metalls purs a partir de minerals mitjançant electròlisi
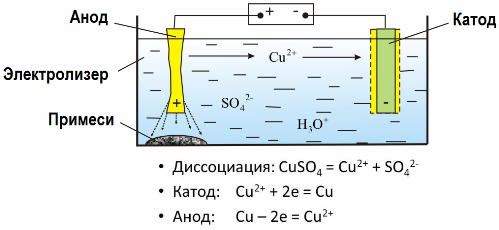
Gràcies a l'electròlisi, molts metalls són extrets de minerals i sotmesos a més processaments. Així, quan el mineral o mineral enriquit (concentrat) és tractat amb reactius, el metall passa a la solució, i el metall s’extreu de la solució mitjançant electroextracció. El metall pur s’allibera alhora al càtode. D’aquesta manera reben zinc, coure, cadmi.
Els metalls estan sotmesos a electrorefiniment per eliminar les impureses i convertir les impureses contingudes en una forma convenient per al tractament posterior. El metall a netejar es cola en forma de plaques i aquestes plaques s’utilitzen com a ànodes en l’electròlisi.
Quan el corrent passa, el metall de l’ànode es dissol, passa en forma de cations a la solució, llavors els cations es descarreguen al càtode i formen un precipitat de metall pur. Les impureses de l’ànode no es dissolen: es precipiten amb la suspensió de l’ànode, o passen a l’electròlit, des d’on s’eliminen contínuament o periòdicament.
Considerem com a exemple electrorefinament de coure. El component principal de la solució - el sulfat de coure - la sal més comuna i més barata d’aquest metall. La solució té una conductivitat elèctrica baixa. Per augmentar-lo, s’afegeix àcid sulfúric a l’electròlit.
A més, s’introdueixen petites quantitats d’additius a la solució per facilitar la formació d’un precipitat de metall compacte. En general, el coure, el níquel, el plom, l'estany, la plata i l'or són sotmesos a refinació electrolítica.
Electròlisi Tractament de les aigües residuals
L’electròlisi s’utilitza en el tractament d’aigües residuals (processos d’electrocoagulació, electroextracció i electroflotació). El mètode de neteja electroquímic és un dels més utilitzats. Per a l'electròlisi s'utilitzen anodes insolubles (magnetita, òxid de plom, grafit, manganès, que es dipositen sobre una base de titani) o solubles (alumini, ferro).
Aquest mètode s'utilitza per aïllar substàncies orgàniques i inorgàniques tòxiques de l'aigua. Per exemple, les canonades de coure es netegen a escala amb una solució d’àcid sulfúric, i les aigües residuals industrials s’han de netejar mitjançant electròlisi amb un ànode insoluble. El coure s'allibera al càtode que es pot tornar a utilitzar en la mateixa empresa.
Les aigües residuals alcalines es purifiquen mitjançant electròlisi a partir de compostos de cianur. Per accelerar l’oxidació dels cianurs, augmentar la conductivitat elèctrica i estalviar energia, s’utilitza un additiu en forma de clorur sòdic a l’aigua.
L’electròlisi es realitza amb un ànode de grafit i un càtode d’acer. Els cianurs són destruïts durant l’oxidació electroquímica i el clor, que s’allibera a l’ànode. L'eficàcia d'aquesta neteja és propera al 100%.
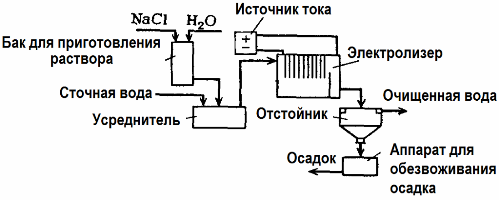
A més de la neteja electroquímica directa, també es pot incloure en el procés d’electròlisi coagulació. Excloent l’addició de sals, l’electròlisi es realitza amb ànodes solubles d’alumini o ferro. Aleshores no només es destrueixen els contaminants de l’ànode, sinó que l’ànode es dissol. Es formen compostos dispersos actius que coagulen (espesseixen) contaminants dispersos col·loides.
Aquest mètode és eficaç per tractar les aigües residuals de greixos, productes petroliers, colorants, olis, substàncies radioactives, etc. Es denomina electrocoagulació.
Galvanoplàstia
El galvanitzat és la deposició electrolítica de determinats metalls per protegir els productes de la corrosió i donar-los un aspecte estètic adequat (el recobriment es fa amb crom, níquel, plata, or, platí, etc.). La cosa es neteja, desgreixa i s’utilitza com a càtode en un bany electrolític on s’aboca una solució salada del metall amb la qual cal revestir el producte.
Una placa del mateix metall s’utilitza com l’ànode. Per regla general, s’utilitzen un parell de plaques d’ànodes i es posa el subjecte a galvanitzar entre elles.
Electroformatge
Galvanitzat: la deposició de metall a la superfície de diferents cossos per reproduir les seves formes: motlles per a peces de fosa, escultures, clics impresos, etc.

La deposició galvànica de metall a la superfície d'un objecte només és possible quan aquesta superfície o tot l'objecte sigui un conductor de corrent elèctric, per la qual cosa és recomanable utilitzar metalls per fabricar models o formes. Els metalls fusionables són els més adequats per a aquest propòsit: plom, estany, soldadures, aliatge de fusta.
Aquests metalls són suaus, fàcilment processats amb eines per a la fabricació de metall, estan ben gravats i fosos. Després de construir la capa galvànica i acabar, el metall del motlle es fosa amb el producte acabat.
Tanmateix, les majors oportunitats per a la fabricació de models encara són representades per materials dielèctrics. Per metal·litzar aquests models, cal donar-li conductivitat elèctrica a la superfície. L’èxit o el fracàs en última instància depèn principalment de la qualitat de la capa conductora. Aquesta capa es pot aplicar d’una de les tres maneres.
La forma més habitual és grafitització, és adequat per a models de plastilina i altres materials que permeten triturar el grafit a la superfície.
El següent truc és broncear, el mètode és bo per a models de forma relativament complexa, per a diferents materials, però, a causa del gruix de la capa de bronze, la transferència de petits detalls està una mica distorsionada.
I finalment plataadequat en tots els casos, però especialment indispensable per a models fràgils amb una forma molt complexa - plantes, insectes, etc.
Fonts de corrent químic
Així mateix, l'electròlisi és el procés principal a causa del qual funcionen les fonts de corrent químic més modernes, com les bateries i els acumuladors. Hi ha dos elèctrodes en contacte amb l'electròlit.
S’estableix una diferència de potencial entre els elèctrodes: una força electromotriu corresponent a l’energia lliure de la reacció redox. Consulteu aquí per a més detalls: Fonts químiques de corrent elèctric
Pila de llimona (feu clic a la imatge per ampliar-la)
L’acció de les fonts de corrent químic es basa en l’ocurrència de processos separats espacialment amb un circuit extern tancat: sobre l’ànode negatiu s’oxida l’agent reductor, els electrons lliures que es formen passen pel circuit extern al càtode positiu, creant un corrent de descàrrega, on participen en la reacció de reducció d’oxidació. Així, el flux d’electrons carregats negativament al llarg del circuit extern va de l’anode al càtode, és a dir, de l’elèctrode negatiu al positiu.
Consulteu també a electro-ca.tomathouse.com
: