Categories: Articles destacats » Electricistes novells
Nombre de visualitzacions: 70526
Comentaris sobre l'article: 0
Cèl·lules galvàniques: dispositiu, principi de funcionament, tipus i característiques principals
Prerequisits per a l'aparició de cèl·lules galvàniques. Una mica d’història. El 1786, el professor de medicina italià, el fisiòleg Luigi Aloisio Galvani va descobrir un fenomen interessant: els músculs de les potes posteriors d’un cadàver acabat d’obrir una granota suspesa en els ganxos de coure es van contraure quan el científic els va tocar amb un bisturí d’acer. Galvani va concloure immediatament que es tractava d'una manifestació d '"electricitat animal".
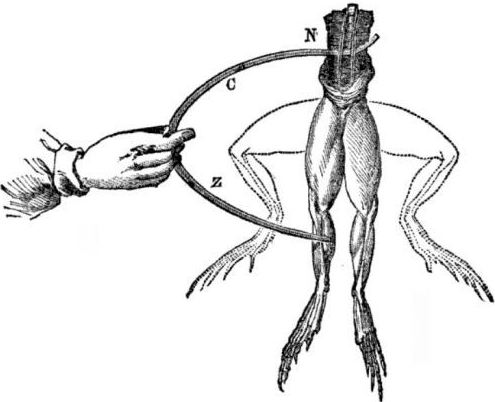
Després de la mort de Galvani, el seu contemporani Alessandro Volta, com a químic i físic, descriurà i demostrarà públicament un mecanisme més realista per a l'aparició de corrent elèctric al contacte de diversos metalls.
Volta, després d’una sèrie d’experiments, arribarà a la conclusió inequívoca que el corrent apareix al circuit per la presència en ell de dos conductors de metalls diferents col·locats en un líquid, i això no és en absolut “electricitat animal”, segons va pensar Galvani. El trencament de les potes de la granota va ser conseqüència de l’acció del corrent derivat del contacte de diversos metalls (ganxos de coure i bisturí d’acer).
Volta mostrarà els mateixos fenòmens que va mostrar Galvani en una granota morta, però en un electròmetre casolà totalment inanimat, i el 1800 donarà una explicació exacta del corrent: “el conductor (líquid) de segona classe està al centre i està en contacte amb dos conductors de primera classe de dos diferents. metalls ... Com a resultat d'això, sorgeix un corrent elèctric d'una o altra direcció. "

En un dels primers experiments, Volta va reduir dues plaques-zinc i coure- en un pot d’àcid i les va connectar amb filferro. Després d'això, la placa de zinc va començar a dissoldre's i es van formar bombolles de gas sobre l'acer de coure. Volta va suggerir i va demostrar que el corrent elèctric flueix pel fil.
Així es va inventar el "element Volta" - la primera cèl·lula galvànica. Per comoditat, Volta li va donar la forma d’un cilindre vertical (pilar), format per anells interconnectats de zinc, coure i tela impregnats d’àcid. Un pol de volt de mig metre d'alçada va crear un voltatge sensible als humans.
Des de l'inici de la investigació el va posar Luigi Galvani, el nom font de corrent químic conservar la memòria d’ell al seu nom.
Cèl·lula galvànica És una font química de corrent elèctric, basada en la interacció de dos metalls i / o els seus òxids en un electròlit, donant lloc a l'aparició d'un corrent elèctric en un circuit tancat. Així, a les cèl·lules galvàniques, l’energia química es converteix en energia elèctrica.
Cèl·lules Avui

Avui les cèl·lules s’anomenen bateries. Hi ha tres tipus de bateries: salines (seques), alcalines (també s’anomenen alcalines, “alcalines” en traducció de l’anglès - “alcalines”) i liti. El principi del seu treball és el que va descriure Volta el 1800: dos metalls interactuar mitjançant electròlitsi apareix un corrent elèctric en un circuit tancat extern.
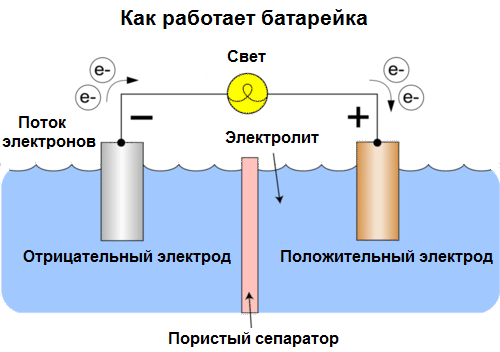
La tensió de la bateria depèn dels metalls utilitzats i del nombre de cèl·lules de la "bateria". Les bateries, a diferència de les bateries, no són capaces de restaurar les seves propietats, ja que converteixen directament l'energia química, és a dir, l'energia dels reactius (reductant i oxidant) que formen la bateria, en energia elèctrica.
Els reactius inclosos a la bateria es consumeixen durant el seu funcionament, el corrent disminueix gradualment, per tant, l’acció de la font s’acaba després que els reactius reaccionin completament.
Els elements alcalins i salats (bateries) s’utilitzen àmpliament per alimentar una gran varietat d’aparells electrònics, equips de ràdio, joguines i liti que es poden trobar més sovint en dispositius mèdics portàtils com els mesuradors de glucosa en sang o en tecnologia digital com les càmeres.

Piles de sal
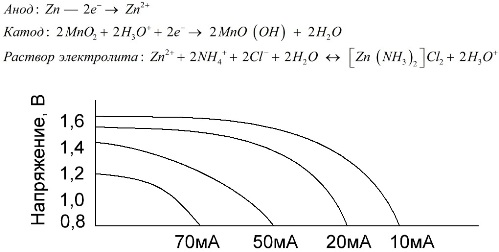
Les cèl·lules de manganès-zinc, que s’anomenen bateries de sal, són cèl·lules galvàniques “seques”, a les quals no hi ha una solució d’electròlits líquids.
Un elèctrode de zinc (+) és un càtode en forma de copa, i una barreja en pols de diòxid de manganès i grafit serveix com a ànode. El corrent flueix a través d’una vara de grafit. Com a electròlit, s'utilitza una pasta a partir d'una solució de clorur d'amoni amb l'addició de midó o farina per espessir-se, de manera que no flueixi res.
Normalment, els fabricants de bateries no indiquen la composició exacta dels elements salats, però, les bateries de sal són les més barates, normalment s’utilitzen en dispositius on el consum d’energia és extremadament baix: en hores, en comandaments a distància, en termòmetres electrònics, etc.

El concepte de "capacitat nominal" rarament s'utilitza per caracteritzar les bateries de manganès-zinc, ja que la seva capacitat depèn molt de les condicions i condicions de funcionament. Els principals desavantatges d’aquests elements són una taxa de reducció significativa de tota la descàrrega i una disminució significativa de la capacitat de sortida amb l’augment del corrent de descàrrega. El voltatge de descàrrega final s'estableix en funció de la càrrega que oscil·la entre 0,7-1,0 V.
És important no només la magnitud del corrent de descàrrega, sinó també el calendari de la càrrega. Amb descàrregues intermitents de corrents grans i mitjans, el rendiment de les bateries augmenta notablement en comparació amb el funcionament continu. No obstant això, amb petits corrents de descàrrega i mesos d'interrupcions en funcionament, la seva capacitança pot disminuir com a conseqüència de l'autocàrrega.
El gràfic anterior mostra les corbes de descàrrega d'una bateria de sal mitjana durant 4, 10, 20 i 40 hores per a la seva comparació amb una alcalina, que es tractarà més endavant.
Piles alcalines (alcalines)
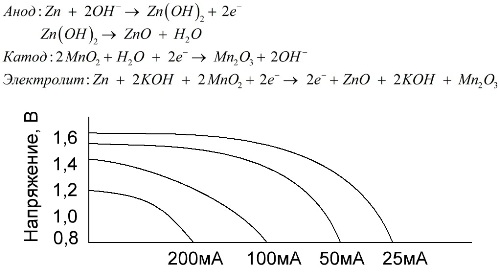
Una bateria alcalina és una bateria galvànica de manganès-zinc, en la qual s’utilitza diòxid de manganès com a càtode, s’utilitza zinc en pols com a ànode i s’utilitza una solució alcalina com a electròlit, generalment en forma de pasta d’hidròxid de potassi.
Aquestes bateries presenten diversos avantatges (en particular, una capacitat significativament més gran, un millor rendiment a temperatures baixes i corrents de càrrega elevada).

Les bateries alcalines, en comparació amb les de sal, poden proporcionar-se més corrent durant molt de temps. Es pot fer un corrent més gran perquè aquí s’utilitza zinc no en forma de vidre, sinó en forma de pols amb una àrea de contacte més gran amb l’electròlit. L’hidròxid de potassi en forma de pasta s’utilitza com a electròlit.
És gràcies a la capacitat d’aquest tipus de cèl·lules galvàniques d’entregar un corrent significatiu (fins a 1 A) durant molt de temps, les bateries alcalines són més habituals en l’actualitat.
A les joguines elèctriques, als equips mèdics portàtils, als dispositius electrònics, a les càmeres, s’utilitzen arreu piles alcalines. Serveixen 1,5 vegades més que la solució salina si el cabal és baix. El gràfic mostra les corbes de descàrrega a diferents corrents per a la seva comparació amb una bateria de sal (el gràfic es va indicar anteriorment) durant 4, 10, 20 i 40 hores.
Bateries de liti
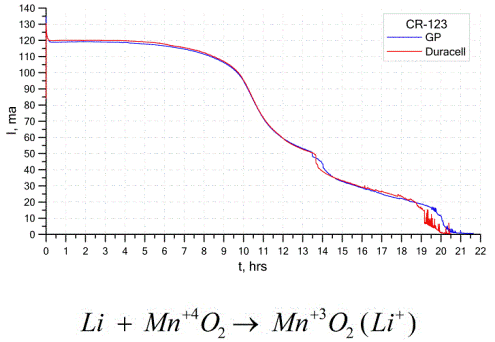
Un altre tipus prou comú de cèl·lules galvàniques són les bateries de liti: cèl·lules galvàniques no recarregables en què s'utilitza liti o els seus compostos com a ànode. A causa de l’ús de metall alcalí, tenen una gran diferència de potencial.

El càtode i l'electròlit d'una cèl·lula de liti poden ser molt diferents, de manera que el terme "cèl·lula de liti" combina un grup de cèl·lules amb el mateix material d'ànode.Com a càtode, per exemple, es pot utilitzar diòxid de manganès, monofluorur de carboni, pirita, clorur de tionil, etc.
Les bateries de liti es distingeixen de les altres bateries pel seu elevat temps d'execució i cost elevat. Segons la mida seleccionada i els materials químics utilitzats, una bateria de liti pot produir tensions des d’1,5 V (compatible amb bateries alcalines) fins a 3,7 V.
Aquestes bateries tenen la màxima capacitat per unitat de massa i una llarga vida útil. Les cèl·lules de liti s’utilitzen àmpliament en equips electrònics moderns portàtils: per alimentar rellotges en plaques base d’ordinadors, per alimentar dispositius mèdics portàtils, rellotges, calculadores, en equips fotogràfics, etc.
El gràfic anterior mostra les corbes de descàrrega de dues bateries de liti de dos fabricants més populars. El corrent inicial era de 120 mA (per resistència de l’ordre de 24 ohms).
Vegeu també Modernes bateries recarregables: avantatges i desavantatges
Consulteu també a electro-ca.tomathouse.com
: