Categories: Articles destacats » Fets interessants
Nombre de visualitzacions: 14188
Comentaris sobre l'article: 1
Per què exploten les bateries
 Els usuaris de telèfons intel·ligents i tauletes són conscients del perill d'explosió de les bateries de liti en els seus aparells. I els exemples sorprenents no han d’anar gaire lluny. Recentment, per exemple, Samsung es va enfrontar personalment a un dolorós problema i es va veure obligat a recordar la primera sèrie de la nova nota 7, ja que les bateries explotaven just en el procés de càrrega. D’una manera o altra, el problema continua sent el mateix des del començament de l’aparició dels telèfons mòbils; fins i tot, el 2016, l’ICAO va prohibir els enviaments comercials als compartiments de càrrega del transport civil. bateries de liti.
Els usuaris de telèfons intel·ligents i tauletes són conscients del perill d'explosió de les bateries de liti en els seus aparells. I els exemples sorprenents no han d’anar gaire lluny. Recentment, per exemple, Samsung es va enfrontar personalment a un dolorós problema i es va veure obligat a recordar la primera sèrie de la nova nota 7, ja que les bateries explotaven just en el procés de càrrega. D’una manera o altra, el problema continua sent el mateix des del començament de l’aparició dels telèfons mòbils; fins i tot, el 2016, l’ICAO va prohibir els enviaments comercials als compartiments de càrrega del transport civil. bateries de liti.
L’essència del problema amb les bateries de liti
El fet és que en el procés de càrrega d’una bateria de liti en un dispositiu mòbil, mitjançant el microcontrolador incorporat a la bateria, s’implementa un algoritme força complicat per implementar aquest procés de manera que la temperatura de la bateria no superi l’interval de temperatures acceptable. El controlador supervisa per a aquest propòsit molts paràmetres de la bateria durant la seva càrrega.
A més del procés de càrrega en si mateix, l’emmagatzematge de la bateria també requereix el compliment de certes regles, especialment pel que fa a la temperatura: no es pot escalfar ni sobrecalentar la bateria.

El principal problema per provocar l'explotació de les bateries és escalfament excessiu de l'electròlit per sobrepassar la temperatura admissible o per un curtcircuit dins de la pila de bateries. La reacció en cadena s’inicia fàcilment a l’interior de la cèl·lula sobreescalfada, perquè el liti de metall alcalí s’encén molt fàcilment, com a resultat que la bateria s’infla i, en el pitjor dels casos, esclata.
I fins i tot malgrat la presència d’un controlador “atent”, es pot produir un defecte de fàbrica accidental (gruix insuficient de l’aïllant entre les cèl·lules) i tenir conseqüències tristes.
Per descomptat, els xocs, les avaries, les punxades, el sobreescalfament al sol són perillosos. Fins i tot si la bateria ha caigut i s’ha llevat lleugerament, es pot produir un desglossament de l’aïllant a l’interior i, en el futur, pot produir un sobtat problema, fins i tot sense un sobreescalfament evident.
Motiu d'explosió de les bateries de liti
L’ànode i el càtode de la bateria d’ió de liti estan separats per un separador de polímer porós. El càtode té sobre ell un material actiu, per al qual sovint s’utilitzen òxids de metalls de transició, en els quals s’incorporen ions de liti. L’ànode sol ser grafit. S’utilitza com a electròlit una solució orgànica de sals de liti.
Durant la primera càrrega a la planta, el liti es va incorporar a l’ànode i es forma una capa d’electròlits descompostos als elèctrodes, que ara serveix de protecció contra reaccions innecessàries, mentre que es manté conductora d’ions.
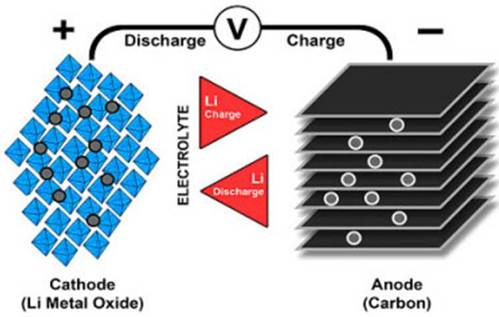
Com s’ha apuntat anteriorment, un curtcircuit intern és una de les principals causes d’autoaccés de la bateria. La causa del curtcircuit en si pot ser un dany físic o defectes de fàbrica, com el tall desigual dels elèctrodes o l’entrada de partícules metàl·liques entre el càtode i l’ànode, que violen la integritat de la capa separadora.
Un altre motiu del tancament és el creixement de les cadenes metàl·liques de liti a través del separador (si els ions de liti a la fàbrica no van disposar de temps suficient per integrar-se plenament en el cristall d’ànode a causa d’una càrrega excessivament ràpida o d’un sobrecobriment, o si la capacitat del material actiu del càtode és més gran que la capacitat de l’ànode, que condueix a dipòsits. a l’ànode, que després creix lentament però inexorablement).
De manera que, si es produeix un curtcircuit, la temperatura de la bateria comença a augmentar i, quan arriba als 70-90 ° C, comença la descomposició de la capa protectora d’ions de l’ànode. L’ànode de liti reacciona amb un electròlit, mentre que s’alliberen hidrocarburs combustibles com l’etilè, metà, età, etc.Però és massa aviat abans del foc, perquè no hi ha prou oxigen.
Mentrestant, la reacció exotèrmica s’activa i la temperatura puja, augmenta la pressió dins de la caixa de la bateria. A 180-200 ° C, comença la reacció de desproporció al càtode, on s’allibera oxigen. Es produeix l'encesa, la temperatura puja bruscament i l'electròlit es descomposa tèrmicament, la temperatura ja és de 200-300 ºC.
Finalment, és el torn del grafit i, quan la temperatura arriba als 660 ° C, l’alumini del col·lector actual comença a fondre’s. La temperatura màxima de tot aquest procés normalment no té temps de superar els 900 ºC, ja que tot acaba ràpidament amb la descomposició completa dels components interns de la bateria.

Ja hi ha èxit en trobar una solució al problema
Per solucionar el problema, els fabricants de telèfons intel·ligents poden endurir la regulació, fer fusibles addicionals en dispositius i bateries, complicar els controladors, però això augmentarà el cost de les bateries i tots els productes que s’ofereixen amb una bateria. Les empreses competeixen entre elles, i senzillament econòmicament no ho poden fer.
Mentrestant, els físics de Stanford lluiten per la seguretat de les bateries de liti, que a l’estiu del 2015 van desenvolupar un mecanisme de protecció especial integrat a la bateria ja en fase de producció.
De fet, estem parlant d’un nou tipus de bateries de liti, que s’apaguen automàticament quan el seu interior arriba a una temperatura potencialment perillosa (que impedeix que el procés doni lloc a un incendi posterior) i, al cap d’un temps, després de refredar-se, es tornen a encendre automàticament.
Els autors del desenvolupament afirmen que es tracta de la primera bateria de liti que es pot apagar i restaurar repetidament sense perdre les seves propietats i el seu rendiment.
El desenvolupament va ser realitzat durant diversos anys per un equip de diverses persones (inclòs Zhenan Bao), per la qual cosa una bateria no tenia dos inconvenients principals: una forta disminució de la capacitat de la bateria després de diversos cicles de recàrrega i, el que és més important, una tendència al foc i a l'explosió per sobreescalfament ( la reacció en cadena s’atura automàticament).
La decisió va arribar a científics d’un camp completament diferent de la física. Feien termòmetres utilitzant nanopartícules de níquel incrustades en una làmina fina de grafè i plàstic. Es tractava de termòmetres poc habituals. En repòs, les partícules de níquel estaven en contacte entre elles, és a dir, es va obtenir un bon conductor de corrent. Però, quan la xapa es va escalfar, el plàstic va començar a expandir-se una mica, cosa que va provocar un debilitament del contacte entre les partícules conductores de níquel i va augmentar la resistència de tot el conductor.
Els investigadors de Stanford van utilitzar aquesta propietat per a la protecció automàtica instantània de les bateries de liti i per a la restauració automàtica completa del contacte després del refredament. Van enganxar una làmina de plàstic a un dels elèctrodes de la bateria de manera que perdria conductivitat amb l'augment de la temperatura. I quan la temperatura arriba als 70 ° C

Però malgrat la solució, els fabricants de dispositius mòbils encara no s’atreveixen a canviar dràsticament la tecnologia de producció de les seves bateries que s’ha desenvolupat al llarg dels anys. Per tant, els usuaris del gadget hauran de posar-se d’acord amb el perill potencial de les bateries de liti durant algun temps i intentar no deixar caure ni sobreescalfar els seus dispositius mòbils, i especialment les bateries. Potser en un futur proper el problema es resoldrà completament.
Vegeu també Ús adequat de les bateries d’ions de liti
Consulteu també a electro-ca.tomathouse.com
:
