Categories: Articles destacats » Electricistes novells
Nombre de visualitzacions: 52646
Comentaris sobre l'article: 4
Transistors Part 2. Conductors, aïllants i semiconductors
Inici de l'article: Historial de transistors, Transistors: finalitat, dispositiu i principis de funcionament
 En enginyeria elèctrica s’utilitzen diversos materials. Les propietats elèctriques de les substàncies estan determinades pel nombre d’electrons que hi ha a l’òrbita de la valència externa. Com menys electrons hi ha en aquesta òrbita, més febles s’associen amb el nucli, més fàcil poden anar a viatjar.
En enginyeria elèctrica s’utilitzen diversos materials. Les propietats elèctriques de les substàncies estan determinades pel nombre d’electrons que hi ha a l’òrbita de la valència externa. Com menys electrons hi ha en aquesta òrbita, més febles s’associen amb el nucli, més fàcil poden anar a viatjar.
Sota la influència de les fluctuacions de temperatura, els electrons es separen de l’àtom i es mouen a l’espai interatòmic. Aquests electrons s’anomenen lliures i creen un corrent elèctric als conductors. Hi ha un espai interatòmic gran, hi ha lloc perquè els electrons gratuïts puguin viatjar per la matèria?
L’estructura de sòlids i líquids sembla contínua i densa, que recorda l’estructura d’una bola de fil. Però, de fet, fins i tot els sòlids s’assemblen més a una xarxa de pesca o voleibol. Per descomptat, això no es pot distingir a nivell de la llar, però mitjançant estudis científics precisos s'ha establert que les distàncies entre els electrons i el nucli d'àtoms són molt més grans que les seves pròpies dimensions.
Si la mida del nucli atòmic es presenta en forma de bola la mida d’una pilota de futbol, els electrons d’aquest model seran de la mida d’un pèsol i cadascun d’aquests pèsols se situa des del “nucli” a una distància de diversos centenars i fins i tot milers de metres. I entre el nucli i l’electró hi ha buit: simplement no hi ha res! Si imaginem les distàncies entre els àtoms de la matèria a la mateixa escala, les dimensions resultaran generalment fantàstiques: desenes i centenars de quilòmetres!
Són bons conductors d’electricitat metalls. Per exemple, els àtoms d’or i plata tenen només un electró a l’òrbita exterior, per tant són els millors conductors. El ferro també condueix electricitat, però una mica pitjor.
Conduir l’electricitat encara pitjor Aliatges d’alta resistència. Es tracta de nichrome, manganina, constantan, fechral i altres. Una varietat d'aliatges d'alta resistència es deu al fet que estan dissenyats per resoldre diversos problemes: elements de calefacció, indicadors de tensió, resistències de referència per a instruments de mesura i molt més.
Per tal d’avaluar la capacitat d’un material per conduir electricitat, el concepte de "Conductivitat elèctrica". El valor de retorn és resistivitat. En mecànica, aquests conceptes corresponen a la gravetat específica.
Aïllants, a diferència dels conductors, no s’inclinen a perdre electrons. En ells, l’enllaç de l’electró amb el nucli és molt fort, i gairebé no hi ha electrons lliures. Més precisament, però molt pocs. Al mateix temps, en alguns aïllants n’hi ha més, i la seva qualitat d’aïllament és, per tant, pitjor. N’hi ha prou de comparar, per exemple, ceràmica i paper. Per tant, els aïllants es poden dividir condicionalment en bons i dolents.
L’aparició de càrregues lliures fins i tot en aïllants es deu a les vibracions tèrmiques dels electrons: sota la influència de la temperatura alta, les propietats aïllants es deterioren, alguns electrons encara aconsegueixen separar-se del nucli.
De la mateixa manera, la resistivitat d’un conductor ideal seria zero. Però, afortunadament, no hi ha cap conductor: imagineu com seria la llei d’Ohm ((I = U / R) amb zero en el denominador. Adéu a les matemàtiques i l’enginyeria elèctrica.
I només a una temperatura zero absoluta (-273,2 ° C), les fluctuacions tèrmiques s’aturen completament i el pitjor aïllant esdevé prou bo. Per determinar numèricament "això" és dolent: utilitzeu bé el concepte de resistivitat. Es tracta de la resistència en ohms d’un cub amb una longitud d’aresta d’1 cm, la dimensió de resistivitat s’obté en ohms / cm. A continuació es mostra la resistència específica d’algunes substàncies.La conductivitat és la reciprocitat de la resistivitat, és la unitat de mesura de Siemens, - 1Sm = 1 / Ohm.
Tenen bona conductivitat o baixa resistivitat: plata 1,5 * 10 ^ (- 6), llegeix com (un a mig i deu a la potència menys sis), coure 1,78 * 10 ^ (- 6), alumini 2,8 * 10 ^ (- 6). La conductivitat dels aliatges amb alta resistència és molt pitjor: constantan 0,5 * 10 ^ (- 4), nichrome 1,1 * 10 ^ (- 4). Aquests aliatges poden ser anomenats mals conductors. Després de tots aquests nombres complexos, substitueix Ohm / cm.
A més, en un grup separat es poden distingir els semiconductors: germani 60 Ohm / cm, silici 5000 Ohm / cm, Seleni 100 000 Ohm / cm. La resistivitat d’aquest grup és més gran que la dels conductors dolents, però menor que la dels mals aïllants, per no parlar dels bons. Probablement, amb el mateix èxit, els semiconductors es podrien anomenar semi-aïllants.
Després d'un coneixement tan curt de l'estructura i les propietats d'un àtom, cal considerar la interacció dels àtoms entre ells, com interaccionen els àtoms entre ells, com es formen molècules dels quals es componen diverses substàncies. Per fer-ho, haureu de recordar els electrons de l’òrbita exterior de l’àtom. Al cap i a la fi, són ells els que participen en l’enllaç dels àtoms en molècules i determinen les propietats físiques i químiques de la matèria.
Com es formen àtoms a partir d’àtoms
Qualsevol àtom es troba en estat estable si hi ha 8 electrons a la seva òrbita exterior. No busca agafar electrons dels àtoms veïns, però no renuncia als seus. Per comprovar-ho, n’hi ha prou a la taula periòdica mirar gasos inerts: neó, argó, kriptó, xenó. Cadascun d’ells té 8 electrons a l’òrbita exterior, cosa que explica la reticència d’aquests gasos a entrar en qualsevol relació (reaccions químiques) amb altres àtoms, per construir molècules de productes químics.
La situació és completament diferent per a aquells àtoms que no tenen 8 electrons apreciats a la seva òrbita exterior. Aquests àtoms prefereixen unir-se amb els altres per complementar la seva òrbita externa amb fins a 8 electrons i trobar un estat estable i tranquil.
Per exemple, la coneguda molècula d’aigua H2O. Consta de dos àtoms d'hidrogen i un àtom d'oxigen, tal com es mostra a la figura. 1.
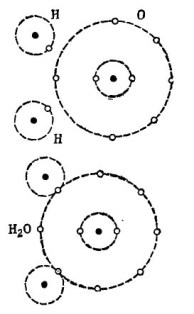
Dibuix 1. Com es crea una molècula d’aigua.
A la part superior de la figura, es mostren per separat dos àtoms d’hidrogen i un àtom d’oxigen. Hi ha 6 electrons a l’òrbita exterior de l’oxigen i dos electrons a dos àtoms d’hidrogen són a prop. L’oxigen fins que l’encarregat número 8 li falten només dos electrons a l’òrbita exterior, que rebrà afegint dos àtoms d’hidrogen a si mateix.
A cada àtom d’hidrogen li falten 7 electrons a la seva òrbita exterior per a una felicitat completa. El primer àtom d’hidrogen rep a la seva òrbita exterior 6 electrons d’oxigen i un altre electró del seu bessó: el segon àtom d’hidrogen. Ara hi ha 8 electrons a la seva òrbita exterior juntament amb el seu electró. El segon àtom d’hidrogen també completa la seva òrbita externa fins al cobejat número 8. Aquest procés es mostra a la part inferior de la figura. 1.
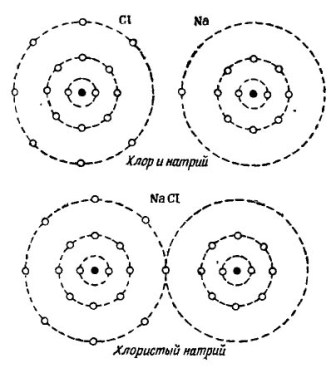
A la imatge 2 Es mostra el procés de combinació d’àtoms de sodi i clor. El resultat és el clorur de sodi, que es ven a les botigues anomenades sal.
Dibuix 2. El procés de combinació dels àtoms de sodi i clor
Aquí, cadascun dels participants rep el nombre d’electrons que falta de l’altre: el clor connecta un sol electró de sodi als seus propis set electrons, mentre que dóna els seus àtoms a l’àtom de sodi. Els dos àtoms de l’òrbita exterior tenen 8 electrons, que és on s’aconsegueix el ple acord i la prosperitat.
València dels àtoms
Els àtoms amb 6 o 7 electrons a la seva òrbita exterior solen unir 1 o 2 electrons a ells mateixos. Diuen sobre aquests àtoms que són un o divalents. Però si a l’òrbita exterior d’un àtom 1, 2 o 3 electrons, aquest àtom tendeix a cedir-los. En aquest cas, l’àtom es considera un, dos o trivalents.
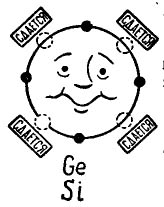
Si hi ha 4 electrons a l’òrbita externa d’un àtom, llavors un àtom prefereix combinar-se amb el mateix, que també té 4 electrons. Així es combinen els àtoms de germani i silici utilitzats en la producció de transistors. En aquest cas, els àtoms s’anomenen tetravalents. (Els àtoms de germani o silici es poden combinar amb altres elements, per exemple, oxigen o hidrogen, però aquests compostos no són interessants en el pla de la nostra història.)
A la imatge 3 es mostra un àtom de germani o silici que vol combinar-se amb el mateix àtom. Els petits cercles negres són els electrons propis de l’àtom i els cercles de llum indiquen els llocs on cauen els electrons dels quatre àtoms (veïns).
Dibuix 3. Àtom de germani (silici).
L’estructura cristal·lina dels semiconductors
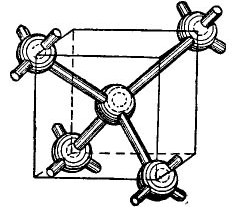
Els àtoms del germani i el silici de la taula periòdica es troben en el mateix grup amb el carboni (la fórmula química del diamant C és simplement grans cristalls de carboni obtinguts en determinades condicions) i, per tant, quan es combinen, formen una estructura cristal·lina similar a la del diamant. La formació d'aquesta estructura es mostra, de forma simplificada, per descomptat, a la figura 4.
Dibuix 4.
Al centre del cub hi ha un àtom de germani, i 4 àtoms més estan situats a les cantonades. L’àtom representat al centre del cub està unit pels seus electrons de valència als seus veïns més propers. Al seu torn, els àtoms angulars donen els seus electrons de valència a l’àtom situat al centre del cub i als seus veïns, àtoms no mostrats a la figura. Així, les òrbites externes es complementen amb fins a vuit electrons. Per descomptat, no hi ha cap cub a la gelosia de cristall, només es mostra a la figura perquè la disposició mútua i volumètrica dels àtoms sigui clara.
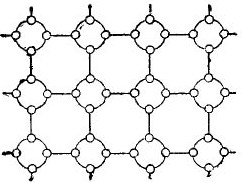
Però per tal de simplificar al màxim la història sobre els semiconductors, la gelosia de cristall es pot representar en forma d’un dibuix esquemàtic pla, malgrat que els enllaços interatòmics es troben tanmateix a l’espai. A tal figura es mostra un circuit. 5.
Dibuix 5. La gelosia de cristall de germani en forma plana.
En un cristall d’aquest tipus, tots els electrons estan fermament units als àtoms mitjançant els seus enllaços de valència, per tant, aparentment, aquí simplement no hi ha electrons lliures. Resulta que al nostre davant hi ha un aïllant a la figura, ja que no hi ha electrons lliures. Però, de fet, no és així.
Conductivitat intrínseca
El fet és que, sota la influència de la temperatura, alguns electrons encara aconsegueixen separar-se dels seus àtoms i, durant algun temps, s’alliberen de l’enllaç amb el nucli. Per tant, existeix una petita quantitat d’electrons lliures en un cristall de germani, a causa del qual és possible conduir un corrent elèctric. Quants electrons lliures existeixen en un cristall de germani en condicions normals?
No hi ha més que dos electrons lliures per 10 ^ 10 (deu mil milions) d’àtoms, per tant, el germani és un conductor pobre, o com es sol dir el semiconductor. Cal tenir en compte que només un gram de germani conté 10 ^ 22 (deu mil milions de milions de) àtoms, cosa que permet "obtenir" uns dos mil milions de electrons lliures. Sembla prou per passar un gran corrent elèctric. Per tractar aquest tema, n’hi ha prou amb recordar quina corrent de 1 A.
Un corrent d’1 A correspon a passar per un conductor en un segon una càrrega elèctrica d’1 Coulomb, o 6 * 10 ^ 18 (sis mil milions de milions d’electrons) per segon. En aquest context, és poc probable que dos mil milions de electrons lliures i, fins i tot, repartits per un enorme cristall, garanteixin el pas de corrents alts. Tot i que, a causa del moviment tèrmic, existeix una petita conductivitat a Alemanya. Es tracta de l’anomenada conductivitat intrínseca.
Conductivitat electrònica i forat
A mesura que la temperatura puja, es transfereix energia addicional als electrons, les seves vibracions tèrmiques es tornen més energètiques, a conseqüència dels quals alguns electrons aconsegueixen separar-se dels seus àtoms.Aquests electrons es tornen lliures i, en absència d’un camp elèctric extern, fan moviments caòtics i es mouen a l’espai lliure.
Els àtoms que han perdut electrons no poden fer moviments aleatoris, sinó que només oscil·len lleugerament en relació amb la seva posició normal a la gelosia de cristall. Aquests àtoms, que han perdut electrons, s’anomenen ions positius. Podem suposar que en lloc d’electrons arrencats dels seus àtoms s’obtenen espais lliures, que normalment s’anomenen forats.
En general, el nombre d’electrons i forats és el mateix, de manera que un forat pot capturar un electró que es troba a prop. Com a resultat, un àtom d'un ió positiu torna a ser neutre. El procés de combinació d’electrons amb forats s’anomena recombinació.
A la mateixa freqüència, els electrons estan separats dels àtoms, per tant, en mitjana, el nombre d’electrons i forats d’un determinat semiconductor és igual a, és constant i depèn de les condicions externes, especialment la temperatura.
Si s’aplica una tensió al cristall de semiconductor, s’ordenarà el moviment de l’electró, un corrent fluirà pel cristall a causa del seu conducte d’electrons i forats. Aquesta conductivitat s’anomena intrínseca, ja es mencionava una mica més amunt.
Però els semiconductors en la seva forma pura, que tenen conductivitat electrònica i forat, no són adequats per a la fabricació de díodes, transistors i altres detalls, ja que la base d’aquests dispositius és la unió p-n (llegiu “pe-en”).
Per obtenir aquesta transició, es necessiten dos tipus de semiconductors, dos tipus de conductivitat (p - positiu - positiu, forat) i (n - negatiu - negatiu, electrònic). Aquest tipus de semiconductors s’obtenen dopant, afegint impureses als cristalls purs de germani o silici.
Tot i que la quantitat d’impureses és molt petita, la seva presència canvia en gran mesura les propietats del semiconductor, permet obtenir semiconductors de conductivitat diferent. Això es tractarà a la propera part de l'article.
Boris Aladyshkin, electro-ca.tomathouse.com
Consulteu també a electro-ca.tomathouse.com
: